作成要領を守って適切な資料作成を!

医薬品業界のパンフレットって作成するためのルールがいろいろあるんですよね。

医薬品なので様々な法規が存在します。そのなかでもパンフレットなどの製品情報資材を作成する一番確認すべきルールブックとしては「医療用医薬品製品情報概要等に関する作成要領」があります。

やっぱり難しい内容なのですか

そうですね。解説付きのものでいうと100ページ超の本のようなものでなかなかのボリュームがあります。今回はその作成要領についてご紹介いたします。
医療用医薬品製品情報概要等に関する作成要領とは
医療用医薬品に関する正確な情報を医療関係者に伝達しなければなりませんが、そのためにはその医薬品の適正な使用を推進することを目的とした資材を作成することが必要です。
医療関係者に提供する適正使用情報は昨今、様々な手段や資材があるので各資材における基本的なルールが必要で、この作成要領は、これらの基本的な事項を定めたものであり、それぞれ使用される状況や内容に応じて位置づけを示しています。
他にも守るべき関連法規があるのでそれらに逸脱していないか確認する必要がありますが、この作成要領を順守して作成すれば他の法規の多くも保管できるのではないかと思います。
作成要領の内容
掲載内容は以下の通りです
Ⅰ.製品情報概要
第1章 基本的留意事項
第2章 総合製品情報概要
第3章 特定項目製品情報概要
Ⅱ.専門誌(紙)掲載広告
第1章 通常広告
第2章 品名広告
第3章 記事体広告
Ⅲ.その他の資材
第1章 プレゼンテーション用コンテンツ
第2章 自社主催・共催の講演会・研究会記録集
第3章 学会場のポスター・展示パネル
第4章 お知らせ文書
第5章 疾患解説資材
第6章 患者向け資材
第7章 製品一覧
第8章 配合変化表
第9章 学会発表・要旨集
第10章 文献別刷り
第11章 文献要旨集
詳細の内容については以下製薬協のホームページよりダウンロードしてご確認ください。

「医療用医薬品製品情報概要等に関する作成要領 (2019.04改定)」「作成要領解説付き (2019.04改定)」とありますがおすすめは後者の解説付きです。
作成要領閲覧のポイント
基本的には作成する資材の種類に合わせて関係する章を確認すればよいのですが、実際にそれだけでは不十分な場合があります。
例えば総合製品情報概要を作成する場合、第1章 基本的留意事項も確認する必要があります。さらに特定項目製品情報概要を作成する場合は、第3章 特定項目製品情報概要だけでなく、第1章 基本的留意事項、第2章 総合製品情報概要まで確認する必要があります。
その他にも臨床成績についての記載がある場合には第2章 総合製品情報概要の内容の確認が必要であったり、そのためには第1章 基本的留意事項の内容が必要だったりと個々の章を見ているだけでは補完できないので注意が必要です。
以下にその資材を作成する場合に順守すべき具体的な項目を表にいたしました。
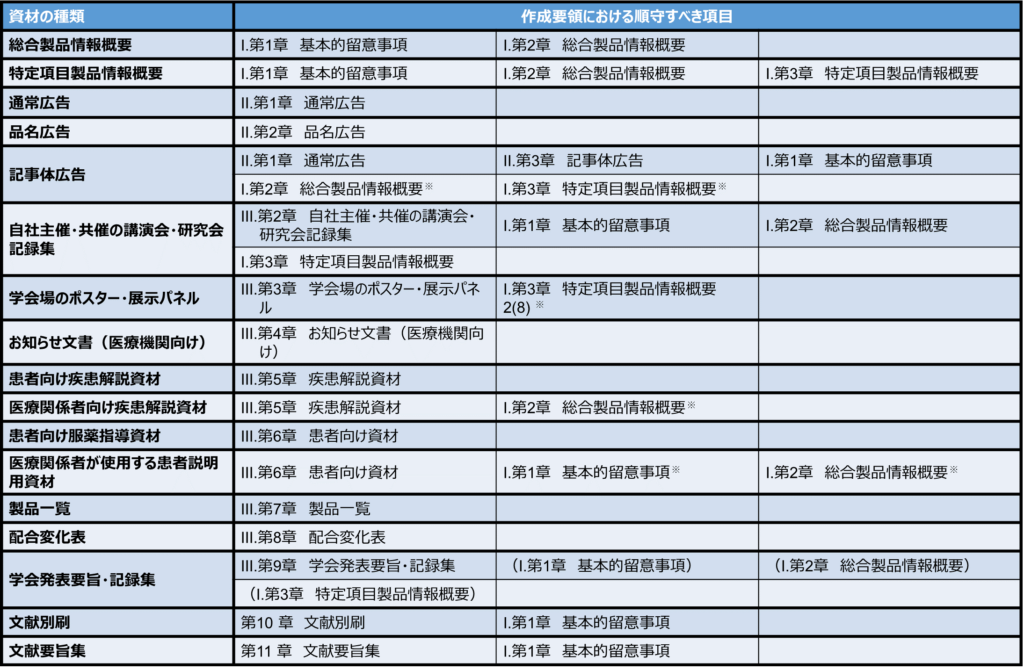
※臨床成績などの項目が掲載されている場合など記載項目によっては確認が必要
作成要領ではだいたいの資材が網羅されているのでその資材の種類に該当するというものについては上記ポイントを確認しながら作成してください。
また、製薬業界で主に使用する資材についての概要は以下の記事に掲載していますので、あわせてご覧いただけますと幸いです。




コメント
記事体広告におけるⅠ.第1章 基本的留意事項は、どのようなときに確認が必要でしょうか?
作成要領を読んでも内容がつかめず、Yさまのご意見を伺う次第です。
ご連絡ありがとうございます。
最近ブログの更新等を行っておりませんでして返答がきているのに気づかず申し訳ございません。
基本的留意事項におきましては、基本的にすべての関連する資材作成に影響してくるものだと考えています。
製品情報概要や特定項目製品情報概要についてはもちろんのこと記事体広告などにおける作成についても注意が必要です。
個人的にはガイドラインの取り扱いについては基本的留意事項の中でも注意が必要な点かと存じます。
ガイドラインに関連する先生方へのご迷惑などにおいて考えても特に注意すべきかと存じます。
回答になっておりましたら幸いです。
よろしくお願い申し上げます。