紹介できる臨床成績の範囲を理解して適切なプロモーションを

あ!この臨床試験すごくうちに有利な結果がでた!資材化して紹介しよう!!

よかったですね。でも、このデータちゃんと紹介できる内容か確認しましたか?

この業界は紹介できるデータにも制限があるんですよね。

そうなのです。ここではそんな紹介できる試験範囲についてご紹介していきます。
※様々な企業や作成者意図によって解釈が異なる可能性がございます。著者の考えを本記事ではご紹介いたしますが、一切責任はもちませんのでご了承ください。
詳細は作成要領など関連法規もあわせてご確認くださいますようお願い申し上げます。
紹介できる範囲
製薬業界においてはその製品の臨床成績を紹介することで、プロモーションを行うことが多いです。
そのプロモーションには各種パンフレットやプレゼンテーション資材などを用いることがあり、
その資材はしっかりとした根拠をもって作成されているものでないとなりません。
製薬企業で主に使用する資材についてはこちらをご確認ください
そういったプロモーション資材を作成するにあたり、その製品が
「すごく効いた!」
「副作用が全然無かった!」など、
その製品をすごく評価したデータがあったとき、プロモーションに有利で紹介したくなるようなものもあります。
しかし、医療業界はそんなに安易にプロモーションできる業界ではありません。
生命に関わる業界ですので偏ったプロモーションの背景に患者さんの不利益があるわけです。
そしてその不利益というのが人の「生き死に」に関わる可能性もあるものなのでそりゃ制限せねばならんということです。
詳しくは以前ご紹介した以下の記事をご覧ください。
つまりプロモーションに使用する資材については扱っても良いデータと扱ってはいけないデータが存在します。
今回は資材化可能な臨床成績データとはどのようなものなのか医療用医薬品製品情報概要等に関する作成要領(以降、作成要領)に基づきご紹介させていただきます。
今回ご紹介する3つのチェック項目を満たしているかどうか確認してみてください。
CHECK 1:根拠データの選定
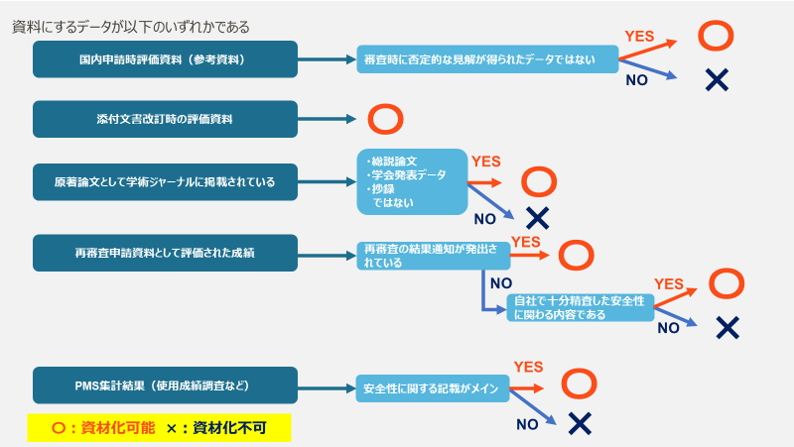
まずは根拠となるデータを取り扱えるかどうかチェックしましょう。
大まかな基準としては
✔ 当局にて評価された臨床成績であるか
✔ ジャーナルでしっかりと査読をうけた臨床成績であるか
✔ 実臨床において安全性に関わる被害を回避するために必要な情報か
というのが紹介できる根拠データかどうかの基準になります。
ですので、基本的には以下の出典であればOKです。
各出典について詳細を以下に説明いたします。
国内申請時評価資料(参考資料)
基本的に承認時申請資料として評価された試験成績は掲載が可能です。
もちろん、審査の結果、否定的な見解を示されたものなどは評価された試験成績には該当しませんので作成出来ません。
ただ、承認時評価資料のうち参考資料や審査過程で照会事項に対する回答として提出され了承された資料などは明確に評価を受けた試験成績として取り扱うことが可能です。
添付文書改訂時の評価資料
添付文書の改訂時に当局に提出し、評価を受けた試験成績も申請時評価資料と同じく、掲載可能です。
特殊な例ですが、条件付き優先審査品等で、最終の試験結果を待たずに承認を受けた品目について、承認条件として情報提供が義務付けられた試験成績なども作成可能です。
原著論文として学術ジャーナルに掲載されている
しっかりと査読を受け厳正な審査が行われるジャーナルに掲載された試験成績であれば作成可能です。
医学の進歩はジャーナルとともにあります。
世界に発信されるものなので、出版するジャーナル側もしっかりと査読した上で発信をしています。Impactfactorなどジャーナルの評価に影響するためテキトーな論文を受け入れられないですよね。
業界でも「このデータは●●に掲載されているから信頼出来る」と称される論文がありますのでジャーナル側もそうなるよう努力しているでしょうし、論文執筆者も有名ジャーナルへの掲載を狙うことが多いと思います。

そういった業界だからこそ医学ジャーナルにちゃんと掲載されているということを科学的な根拠としているんですね。
ただし、
✔ 学会発表
✔ 総説論文
は掲載NGです。
学会発表データは基本的に論文化されるより公表が早いです。
最新データを紹介したいという企業の想いや、最新治療を世に広めたいという先生方もいますが、
詳細な内容を確認することが難しかったり、
最終的に論文化されたときに、データの詳細や結果が完全に一致しなかったり
ということが少なくありません。
総説論文は、試験方法など詳細が明らかではない場合が多いですし、
引用されている個別のデータ自体について審査が行われるものではありません。
以上から学会発表・総説論文は資材化できないわけですね。
再審査申請資料として評価された成績
再審査の結果が出れば、その有効性と安全性について紹介可能です。
また、再審査期間中(再審査申請前)であっても重篤な有害事象リスクが見つかったりした場合は審査完了まで安全性情報を公開しないというのはとても危険なことですよね。
そういった場合、販売会社は自社で十分精査し安全性に関わる成績は紹介可能です。
有効性にかかわるような情報は審査期間中の場合はNGです。
PMS集計結果(使用成績調査など)
使用成績調査などのPMS集計結果が論文化された場合は基本的に、
安全性に関する記載をメインとして、
タイトルにはPMS集計結果(中間集計、最終集計)である旨を記載
すれば作成可能です。
CHECK 2:臨床比較試験が含まれているか

臨床比較試験は、2群間以上を比較して優越性(例:効果が勝っているよを証明する)や非劣性(例:効果は同等だよ、他の面でメリットがあるから効果の同等性さえ出せれば十分だよ)などを検証する試験です。
製薬業界では既に使われている薬よりも優れた結果を出さないと医療関係者にあまり使ってもらえません。
これは取り扱っているのが薬剤という生命に関わるものであることが背景にあります。
効果や副作用がどれくらい発現するなどの情報は、臨床現場で使用されればされるほど情報が蓄積されるので対応がしやすくなっていきます。
そのため医療関係者もその薬を使う経験値と安心感があります。
しかし、新薬はデータが特定の患者群で行った、現実の世界と比べると小規模な試験のみのため、現場で使ってみると未知の副作用が発現したり投与方法に難があったり、効果があまり出なかったりなどのリスクがあります。
そこで新薬は基本的に現在の標準治療薬をコントロールアームにおいて試験を行います。
今の薬より、「効果が高い!」とか「安全に使用できる!」という結果があればそりゃ現場も使うわけです。
こういった背景から臨床比較試験というものはプロモーションの鍵を握るわけですね。
ただ、先ほどの根拠資料でもそうですが、再現性や科学的根拠をとても大切にする業界です。
統計解析をしっかりと行った比較試験でないと医療関係者に流布することは認めてもらえません。
そういう背景のため以下の比較試験であれば紹介してもよいということになっています。
CHECK 3:各種制限に逸脱しないか
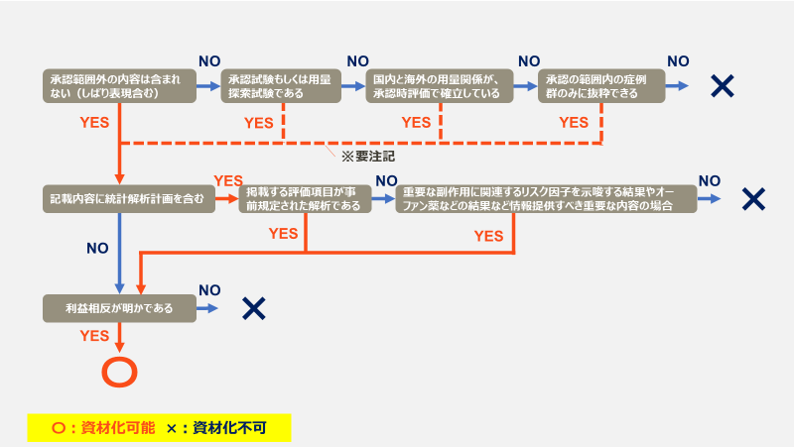
上記を満たしていてもまだ掲載できるとは限りません。
基本的には当局にて評価された根拠データであれば(その臨床成績を元に適応が追加されたりしていると思うので)、ほぼ次にご紹介する項目はクリアされると思いますが、すべてとは限りませんので注意が必要です。
また、当局提出されていない原著論文として学術ジャーナルに掲載されているが根拠とする場合は特にしっかりとご確認が必要です。
以下の点をしっかりとチェックしましょう。
承認範囲外の内容が含まれていないか
有効性を紹介するデータは、国内データ、海外データを問わず、原則として承認を受けた効能又は効果、用法及び用量の範囲内で記載する必要があります。
仮に承認外のデータが周知された場合、その治療法が適応範囲外なのに使われてしまう可能性があるからです。
様々な事情がありますが、基本的には”適応が得られていない”=”有効性及び安全性が確立していない”ことを表します。
再現性を大切にするこの業界では確立していない治療は推奨できません。
ただし、以下の場合は承認範囲外であっても紹介が可能です。
その他、3群間の試験データなどにおいて、1つのグループが承認外の治療グループの場合、そのグループを削除した2群間のデータにて紹介することが可能です。
ただし、削除理由などにおいてはしっかり明記しましょう。再解析などもNGですよ。
記載内容に統計解析計画を含むか
学術論文で有効性を評価する場合、統計解析で優越性や、非劣性(同等な効果があるよ)が検証されたといった結果を用いることが一般的で、医師の先生方もこの統計計画に注目して論文を見ています。
再現性を求められるこの業界で統計結果は欠かせない情報です。
そのためこの統計解析計画については様々な取り決めがあります。
事前規定された解析であるか
この統計解析というのは比較している両群間の差がこれくらいでたら仮説が検証されるといった指標を事前に設定しておく必要があります。
後から「ちょっと差がでたからA群は効果が期待出来るね」といったことは言えないわけです。
事後的な解析結果の場合は、たまたま得られた結果である可能性を払拭できませんので、再現性が確かめられた結果であるとはいえません。

事前計画の指標を達成したor達成していないかで評価されるシビアな世界なんですね。
また、統計解析結果(主要・副次評価項目、サブグループ解析結果など)を記載する場合は、
解析計画に解析方法を記載する必要もあるのであいまいな状態では紹介できません。
例えば、出典論文内に主要評価項目の統計解析計画は記載されているのに、サブグループ解析計画は掲載されていない場合があるとします。
その場合、
解析計画が明記されている主要評価項目は紹介できますが、
解析計画が明記されていないサブグループ解析のほうは紹介できないわけです。

ちゃんと書いててほしいですね。

論文中の文字数上限が決まっているジャーナルなどもありますし、主題の邪魔になることもあります。
執筆者が伝えたいことを論文化しているということをご理解ください。
また、出典通りに作成したと思っていても論文化の際のデータと承認申請時の社内データで異なる場合などもあります。
こういったものの中には当初の解析計画とは異なる再解析が行われ論文化されているものもあります。
そういった場合は論文化されていたとしても事前規定されたものではないので紹介はできないことを覚えておきましょう。
事後解析でも紹介できるCase
事後解析であっても情報提供が重要である場合、例えば、以下の内容であれば掲載可能です。
✔ 重要な副作用に関連するリスク因子を示唆する結果、
✔ 統計的な有意性を示すことができないオーファン薬等で有効性の根拠とされた集計結果等
あくまで事後解析ですので、掲載の際は「 ○○である可能性が考えられた」などの控えめな表現を用いましょう。
利益相反が明らかであるか
利益相反(COI)は、製薬企業が関与した臨床研究の結果について、臨床研究の研究者(医療関係者等)との関与について明らかにするために記載します。
この自社との利益相反がある場合は、書誌事項とともに記載しましょう。
ただし、出典論文中に利益相反の記載が無い場合があります。
その場合はしっかり社内でその臨床試験との関わりがあったかどうか確認し、関与の有無を確認しましょう。
関与があった場合はしっかりと利益相反について記載しましょう。
古いデータでわからない場合は、書いてないから関与がないだろうと記載しないという判断は危険です。
不明な場合は掲載しないことをおすすめします。




コメント